Резюме. В лекции обобщен опыт использования а-липоевой кислоты (Тиогаммы) в качестве антиокси-данта для лечения сахарного диабета, его осложнений и заболеваний печени. Применение а-липоевой кислоты повышает эффективность лечения диабетической невропатии, жирового гепатоза и расширяет возможности патогенетической терапии сахарного диабета и заболеваний печени. Ключевые слова: а-липоевая кислота, сахарный диабет, невропатия, жировой гепатоз.
В организме человека ежедневно образуются триллионы свободных радикалов кислорода. Они возникают везде там, где изменяется химическая структура вещества, и это связано с обменом веществ. Свободные радикалы образуются при дыхании, пищеварении, продукции тепла и производстве энергии, росте, регенерации, а также при удалении продуктов обмена веществ. Существует тесная взаимосвязь между обменом веществ и образованием свободных радикалов: чем выше активность обменных процессов, тем больше их образуется. Это не должно приводить к ложному заключению, что еда, дыхание, прием жидкости и движение в конечном итоге являются патологией, поскольку при всех этих процессах увеличивается количество свободных радикалов.
В течение миллионов лет у всех высших форм жизни сформировалась специфическая система, которая в процессе обмена веществ выполняет роль «ловушки» (нейтрализации) свободных радикалов и таким образом подавляет их химическую агрессивность. Свободные радикалы кислорода играют и положительную роль, так как их продукция необходима для поддержания чистоты внутренней среды — они разрушают чужеродные вещества, вирусы и бактерии. Сильно изменившиеся в последнее столетие условия жизни (загрязнение воздуха, накопление инсектицидов и пестицидов в пищевых продуктах, лучевая нагрузка, электросмог, стрессы) привели к тому, что естественные регуляторы больше не в состоянии нейтрализовать избыточное образование свободных радикалов, что вызывает развитие оксидативного стресса.
Роль оксидативного стресса в патогенезе осложнений сахарного диабета
Хроническая гипергликемия, являющаяся основным и объективным признаком наличия сахарного диабета (СД), участвует в патогенезе как сахарного диабета
per se, так и его сосудистых осложнений [5, 11]. Это влияние гипергликемии осуществляется как непосредственно, так и опосредованно — инициацией нескольких биохимических процессов, к которым относятся:
— оксидативный стресс, развивающийся как следствие повышенного аутоокисления глюкозы;
— снижение активности антиоксидантной защиты;
— избыточное образование конечных продуктов неферментативного гликирования и их взаимодействие с соответствующими рецепторами;
— повышенная активизация протеинкиназы С, усиление полиолового обмена глюкозы и нарушение обмена липопротеидов.
Все перечисленные механизмы участвуют не только в патогенезе сосудистых и нервных осложнений СД, но и в механизмах инсулинорезистентности и нарушениях функции р-клеток поджелудочной железы при СД 2-го типа. Можно выделить три направления, в которых оксидативный стресс играет ведущую роль [12, 13]:
— оксидативный стресс играет доминантную роль в возникновении сосудистых осложнений СД — микро- и макроангиопатий;
— оксидативный стресс может способствовать возникновению инсулинорезистентности и таким образом — манифестации СД 2-го типа;
— свободные радикалы кислорода также образуются в р-клетках поджелудочной железы, их цитотоксическое действие вносит вклад в разрушение р-клеток (апоптоз) и таким образом вызывает нарушение секреции инсулина и инсулиновую недостаточность.
Заболевания печени
Оксидативный стресс играет важную роль в патогенезе значительного количества заболеваний человека: ишемической болезни сердца, заболеваний сосудов, бронхолегочного аппарата, головного мозга, желудочно-кишечного тракта, преждевременного старения, рака, поражений печени и др. [3, 6].
Особое значение в поражении печени имеет свобод-норадикальное окисление. Печень занимает центральное место в обмене веществ и обезвреживании значительного количества эндогенных токсинов и экзогенных ксенобиотиков. Липидная пероксидация является важным механизмом обезвреживания многих чужеродных веществ. Это позволяет превратить плохо растворимые в воде токсины в растворимые соединения и вывести их из организма. Особенно благоприятные условия для возникновения оксидативного стресса создает такое распространенное явление, как жировая инфильтрация печени. В современной практике выделяют жировой гепатоз алкогольного и неалкогольного генеза. В определенных условиях эта патология может прогрессировать до стеато-гепатита, который у определенного количества пациентов прогрессирует до цирроза.
Современное и очень логичное объяснение патогенеза процесса прогрессирования жировой инфильтрации печени в стеатогепатит и далее представлено гипотезой «двух ударов» (C. Day, O. Janes, 199

.
Первый «удар» состоит в накоплении жира, являющегося основой жировой дегенерации печени. Последняя увеличивает чувствительность органа ко второму «удару». Жировой гепатоз остается только гепатозом до тех пор, пока не состоится второй «удар». Он может быть вызван приемом определенных лекарственных препаратов, развитием СД 2-го типа, шунтированием тонкого кишечника для снижения массы тела, парентеральным питанием и т.д.
Внезапное повышение уровня свободных жирных кислот (СЖК) играет решающую роль в этой ситуации. В гепатоцитах СЖК либо окисляются, либо используются для синтеза триглицеридов, фосфолипидов и эфи-ров холестерина. Высокоактивированный метаболизм жиров связан с увеличением количества свободных радикалов, т.е. с окислительным стрессом. Печень, которая не подвержена жировой дегенерации, спокойно реагирует на второй «удар». Однако жировой гепатоз делает печень более чувствительной ко второму «удару» и сопровождается повышением интенсивности окисления липидов и дальнейшим увеличением количества свободных радикалов. Свободные радикалы способны атаковать двойные связи ненасыщенных жирных кислот, что приводит к их расщеплению. Следовательно, свободные радикалы повреждают клеточные мембраны, мембраны клеточных органелл, важные ферментные системы и ядерные ДНК. Важными продуктами деградации метаболизма жиров являются малоновый диальдегид и 4-гидроксиноненаль, которые ковалентно связываются с белками клеток, индуцируя экспрессию аутоантигенов. Посредством этого они отвечают за иммунные реакции, наблюдаемые при стеатогепатите.
Антиоксидантное действие а-дипоевой кислоты (АЛК)
В многочисленных исследованиях показано, что в организме АЛК является системой важных антиокси-дантов и, кроме того, сама по себе служит эффективной ловушкой для свободных радикалов [4, 7] (рис. 1).
Антиоксидантный эффект АЛК обусловлен наличием двух тиоловых групп в молекуле, а также способностью связывать молекулы радикалов и свободное тканевое железо, предотвращая его участие в перекисном окислении липидов. Получены убедительные доказательства того, что АЛК не только обладает самостоятельным антиоксидантным потенциалом, но и обеспечивает мощную поддержку работы других антиоксидантных звеньев в организме [3, 10]. В этом отношении ее протек-тивное действие тесно связано с гомеостазом в системе глутатиона и убихинона. АЛК и дигидрооксилипоевая кислота могут способствовать очищению от перекиси водорода и НОО, в то время как дигидролипоевая кислота способствует очищению от Н2О2. При перекисном окислении липидов образуются пероксильные радикалы с распространением реакции. Дигидролипоевая кислота способствует очищению от этих свободных радикалов, образованных от генераторов гидрофильных пероксильных радикалов. Таким образом, комплекс ли-поатов представляет собой возможную систему очистки от потенциальных свободных радикалов.
Дигидролипоевая кислота также осуществляет рецикл витамина Е при снижении уровня глутатиона, который впоследствии восстанавливает радикалы витамина Е. Следовательно, существует комплекс антиок-сидантов, с которыми дигидролипоевая кислота может взаимодействовать и поддерживать как липидный, так и водный антиоксидантный статус.
Использование а-липоевой кислоты (Тиогаммы) в качестве антиоксиданта
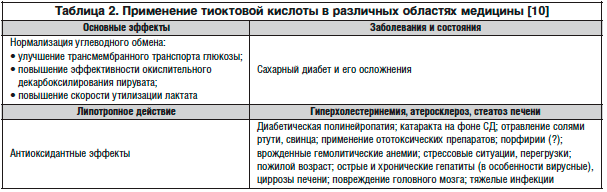
Учитывая роль окислительного стресса в развитии самого СД, его осложнений, в частности диабетической нейропатии и ангиопатии, актуальное значение приобретает проблема разработки фармакологических средств регуляции этих процессов [1]. В последнее время для уменьшения оксидативного стресса и нормализации процессов перекисного окисления липидов широкое применение получили ингибиторы свободнорадикального окисления — антиоксиданты. Следует отметить, что способностью непосредственно реагировать с перекисными радикалами липидов обладают только антиоксиданты, причем их влияние на общую скорость свободнорадикального окисления значительно превышает эффективность воздействия других систем. Особый интерес в связи с этим представляет такой анти-оксидант, как а-липоевая кислота (препарат Тиогамма производства компании «Верваг Фарма ГмбХ и Ко. КГ» (Германия)). Тиогамма выпускается в таблетках, ампулах и флаконах (Тиогамма Турбо). Тиогамма Турбо производится во флаконах по 50 мл, готовых для инфузи-онного введения, что позволяет получить необходимую дозу АЛК в значительно меньшем объеме жидкости, уменьшая тем самым водную нагрузку на организм.
Общие данные
АЛК — это эндогенно образованное вещество, которое, будучи по своей природе естественным метаболитом, принимает участие во многих физиологических процессах, связанных с обменом веществ, и является эффективным средством метаболической фармакотерапии. АЛК действует как коэнзим в мультиферментных комплексах митохондрий, которые ускоряют окислительное декарбоксилирование а-кетокислот.
Через ферментативное и химическое восстановление из АЛК синтезируется дигидролипоевая кислота. Система а-липоевая/дигидролипоевая кислота выполняет антиоксидантную функцию в организме, активируя такие системы, как глютатионовая, витаминов С/Е, цистеин/цистин.
Клиническое применение АЛК
Сахарный диабет
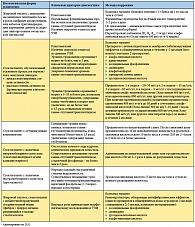
Основным клиническим направлением, в котором широко используются препараты АЛК (Тиогамма, «Верваг Фарма ГмбХ и Ко. КГ» (Германия)), является практическая диабетология [2, 8]. Проведенные клинические исследования препаратов АЛК в первую очередь доказали их высокую эффективность при лечении диабетических поражений нервной системы. Терапевтическая эффективность препаратов АЛК при поражениях нервной системы у больных СД обусловлена прежде всего патогенетической направленностью их действия и способностью активно накапливаться в периферической нервной системе. Клиническое применение АЛК для лечения диабетической полиневропатии началось в 50-е годы прошлого века с применения вводимых внутривенно или перорально небольших доз препарата (50—300 мг). Впервые эффективность в/в введения АЛК с позиций доказательной медицины была подтверждена в исследовании ALADIN [14]. Оно оказало наибольшее влияние на использование АЛК для лечения диабетической полиневропатии, т.к. в нем впервые был показан дозозависимый эффект АЛК при этом осложнении СД.
Стало известно, что небольшие дозы АЛК, которые использовались в исследованиях до этого (50—300 мг), не способны привести к уменьшению симптомов диабетической полиневропатии, и назначать дозу препарата менее чем 300 мг нецелесообразно. Из исследований ALADIN следовало несколько заключений:
— эффективность и безопасность лечения диабетической полиневропатии АЛК доказаны в контролируемых исследованиях;
— внутривенное введение АЛК имеет дозозависи-мую эффективность в отношении позитивной невропатической симптоматики, причем доза 600 мг является оптимальной, т.к. доза 1200 мг не увеличивает эффективность лечения. В связи с этим понятно, что не следует увеличивать дозу в/в введения АЛК сверх 600 мг;
— эффективности 14 инфузий в дозе 600 мг АЛК недостаточно для уменьшения неврологического дефицита. Последнее заключение было опровергнуто в исследовании ALADIN III, в котором применялось в/в введение 600 мг АЛК или плацебо в течение 3 недель. Исследование показало возможность уменьшения неврологического дефицита, обусловленного диабетической полиневропатией, у больных СД 2-го типа при в/в введении АЛК.
Исследование DEKAN показало, что при продолжительном наблюдении за 73 пациентами, которые страдали СД, пероральная терапия АЛК (800 мг ежедневно на протяжении 4 месяцев) оказывает положительное влияние на клиническую симптоматику вегетативной диабетической полиневропатии [9].
Изучение эффективности в/в 3-недельного введения АЛК амбулаторным больным СД 1-го и 2-го типов с диабетической полиневропатией в сравнении с группой больных СД с полиневропатией, получавших в/в введение плацебо, выполнено в 33 диабетологических центрах США, Канады и Европы в исследовании NATHAN II. Тестирование по шкалам TSS и NIS подтвердило результаты предыдущих исследований улучшения позитивной невропатической симптоматики. Подводя итог всем исследованиям, можно отметить, что улучшение, которое наблюдалось у больных с диабетической полиневропатией при назначении АЛК, касалось позитивной неврологической симптоматики (ощущение боли, онемения, жжения и парестезий), негативной неврологической симптоматики (неврологического дефицита — снижение чувствительности всех модальностей, рефлексов на ногах и силы мышц) и данных электрофизиологических исследований.
После окончания 3-недельного курса в/в капельного введения АЛК в дозе 600 мг в течение первого месяца наблюдается дальнейшее улучшение состояния по шкале TSS, которое в дальнейшем сохраняется в течение
6 месяцев (I. в^окоу и соавт., 2004). АЛК может вводиться в/в капельно в дозе 600 мг в течение 15 дней или назначаться в виде таблеток в дозе 600 мг ежедневно утром натощак в течение 2 месяцев.
В Украине в настоящее время зарегистрировано 5 препаратов АЛК.
Методика проведения антиоксидантной терапии с помощью АЛК (Тиогамма, «Верваг Фарма ГмбХ и Ко. КГ» (Германия))
Методика лечения больных СД с полиневропатией препаратами АЛК достаточно хорошо отработана, и имеется большой клинический материал по ее использованию [15].
Лечение начинают с в/в введения препарата Тиогамма («Верваг Фарма ГмбХ и Ко. КГ» (Германия)) в разовой дозе 600 мг в течение 14—15 дней. Учитывая возможность введения в стационаре или амбулаторно (нерабочие дни медперсонала), АЛК обычно вводится 5 дней подряд, затем следуют 2 дня перерыва, и такие циклы повторяются 3 раза. Возможен прием таблеток (или капсул) АЛК в дни, когда не делаются инфузии препарата. Использование более коротких курсов в/в введения АЛК (до 10 инфузий) не позволяет в подавляющем большинстве случаев добиться существенного улучшения состояния больных. При инфузиях препаратов АЛК не следует забывать о необходимости затемнения флакона с раствором, т.к. АЛК легко окисляется на свету и теряет свою эффективность. Для этого используют стандартное обертывание флакона с раствором АЛК фольгой. Тиогамма Турбо («Верваг Фарма ГмбХ и Ко. КГ» (Германия)) выпускается в флаконах из темного стекла, что облегчает использование без светозащитных футляров.
Исследования эффективности АЛК при диабетической полиневропатии позволяют считать обоснованным использование после окончания курса инфузий в течение 2—3 месяцев таблеток АЛК. Целесообразной дозой АЛК для проведения пролонгированной терапии диабетической полиневропатии после окончания курса инфузий можно считать 600 мг.
Важным достоинством АЛК является низкая частота побочных действий. Так, во всех контролируемых исследованиях отмечалось, что частота нежелательных эффектов в группе больных, получавших АЛК и плацебо, статистически не отличалась. Побочные эффекты АЛК не являются тяжелыми, и их частота дозозависи-ма. При в/в введении АЛК в исследовании ALADIN побочные эффекты (головная боль, тошнота, рвота) чаще отмечались при дозировке 1200 мг (32,6 %), чем при дозировке 600 мг (18,8 %) и введении плацебо (20,7 %). Кроме того, при скорости проведения инфузии более
50 мг/мин наблюдались повышение АД, тахикардия и затруднения дыхания. С точки зрения местной и общей непереносимости не установлено явных различий между этилендиаминовой и трометамоловой солью при в/в введении. В среднетерапевтических дозах (в зависимости от формы выпуска и дозировки конкретного препарата) прием АЛК безопасен. Клинического испытания применения АЛК у беременных не проводилось.
Взаимодействие с другими лекарственными препаратами
В связи с нерастворимостью АЛК в воде для парентерального введения используется ее раствор с 0,5—1% натриевой солью. С молекулами сахара АЛК образует малорастворимые комплексы, в связи с чем она несовместима с раствором глюкозы, раствором Рингера и т.д.
При одновременном приеме АЛК и антидиабетических средств (пероральных препаратов или инсулина) в связи с повышением чувствительности к инсулину могут наблюдаться гипогликемические состояния, что требует корректировки дозы гипо-гликемизирующих средств в сторону уменьшения. Во время лечения препаратами липоевой кислоты не рекомендуется употребление алкоголя, т.к. под его воздействием снижается ее терапевтическая эффективность.
Противопоказания к назначению АЛК
Определенными ограничениями для в/в введения АЛК являются возраст старше 75 лет, свежие геморрагии на глазном дне и наличие в настоящее время нарушений ритма сердца.
Наиболее четким и обобщающим выводом о целесообразности использования АЛК при диабетической полиневропатии явилось высказывание декана медицинского факультета университета профессора Н.П. Люпке: «Альфа-липоевая кислота как препарат для лечения больных с симптомами диабетической полиневропатии сегодня является терапевтическим средством специфической терапии, успешно прошедшим клинические испытания, с хорошей переносимостью и минимальным риском».
Использование АЛК в клинической гепатологии
Универсальные биологические и фармакологические эффекты создают мощные предпосылки для применения препаратов АЛК во многих других направлениях, в первую очередь в гепатологии. Можно выделить несколько основных свойств АЛК, которые обосновывают ее применение для лечения заболеваний печени.
Наличие тиоловых групп в молекуле АЛК придает ей свойства антиоксиданта.
Применение АЛК поддерживает и другие звенья клеточной антиоксидантной защиты в рабочем состоянии. В частности, АЛК способствует поддержанию физиологического равновесия в системе глутатиона и убихинона, коэнзима Q10.
АЛК существенно замедляет жировое перерождение печени, обладает антиатератогенными свойствами. Сфера применения АЛК в гепатоло-гии охватывает следующие заболевания печени: неалкогольная жировая болезнь печени, вирусный гепатит и фиброз печени. Благодаря нормализации обменных процессов и восстановлению окислительно-восстановительного равновесия в гепато-цитах АЛК снижает повреждающее воздействие токсических веществ, т.е. оказывает протективное действие на печень. Антиоксидативный потенциал АЛК способствует более эффективной репарации молекул ДНК после повреждения в результате окислительного стресса. Особыми показаниями для применения АЛК являются жировой гепатоз и его последствия.
Неалкогольная жировая болезнь печени (жировой гепатоз и неалкогольный стеатогепатит) в 80 % случаев протекает в сочетании с такими патологическими состояниями, как СД 2-го типа, ожирение, дислипидемия, артериальная гипертензия, формируя картину так называемого метаболического синдрома. Для коррекции липидного обмена в ге-патоцитах и уменьшения воспалительных явлений в печени показана антиоксидантная терапия с помощью АЛК. Получены данные о снижении инсулино-резистентности, т.е. восстановления чувствительности к инсулину под влиянием антиоксидантной терапии с помощью АЛК, глутатиона и коэнзима Q10 (G. Kelly и соавт., 2000).
В исследовании, проведенном T. Konrad и соавт. (1999), изучался эффект АЛК (600 мг 2 раза в день на протяжении 4 недель) на чувствительность к инсулину, эффективность ассимиляции глюкозы и содержание пирувата и лактата после ОТТГ у больных СД 2-го типа с избыточной и нормальной массой тела. Лечение больных СД 2-го типа АЛК сопровождалось достоверным снижением уровня лактата, пирувата, инсулинорези-стентности и повышением ассимиляции глюкозы тканями-мишенями.
При неалкогольной жировой болезни печени АЛК может рассматриваться как средство, эффективно воздействующее на одно из основных звеньев патогенеза заболевания — оксидативный стресс. Необходимо ясно понимать, что печень является основным органом, в котором метаболизируется АЛК. Применение препаратов АЛК в клинической гепатологии имеет большой и, по всей видимости, еще не оцененный должным образом лечебный потенциал. Все это требует дальнейшего проведения клинических исследований при заболеваниях, особенно это касается заболеваний печени, в которых оксидативный стресс является одним из основных патогенетических факторов. Таким образом, на основании многих исследований можно заключить, что АЛК является мощным ан-тиоксидантом (по существу — суперантиоксидантом), представляет собой препарат для лечения различных осложнений СД, особенно невропатии, инсулиноре-зистентности, дисфункции эндотелия, атеросклероза, заболеваний печени. АЛК оказывает многоплановое положительное действие не только на течение диабетической невропатии, но и на прогрессирование СД в целом, и должна применяться в комплексном лечении сахарного диабета.